服务介绍:
肿瘤动物模型是肿瘤病因学、发病机制以及防治等研究的重要工具。当前恶性肿瘤已经成为我国导致死亡的主要疾病之一,病死率位居第I位,恶性肿瘤患者常因肿瘤转移而导致预后不佳的情况,常规恶性肿瘤转移途径主要包括血液转移、腹膜转移和淋巴转移等,肝脏是最主要也是最常见的被转移器官。目前实验室采取脾脏膜下接种细胞方式构建肝转移瘤模型并以此模型进行肝转移瘤疾病发生机制和药物筛选的研究。
名称 | 规格 | 价格(元) |
小鼠肝转移瘤(脾转肝) | 只 | 800起(方案询价) |
实验结果展示:
1、肝转移瘤照片
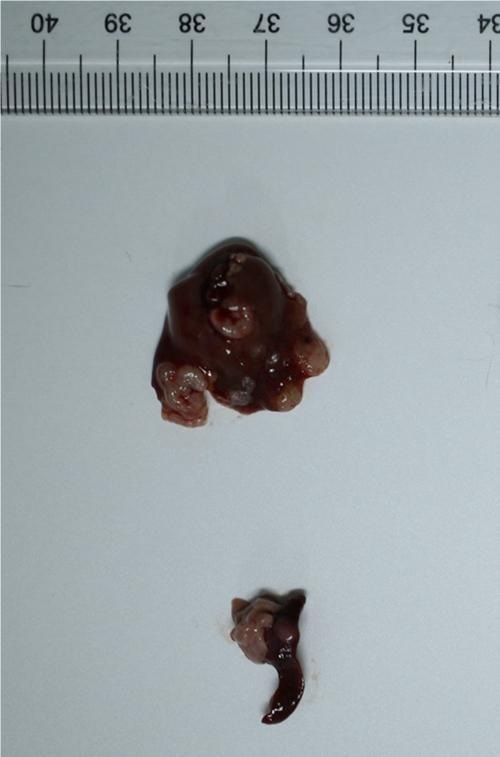
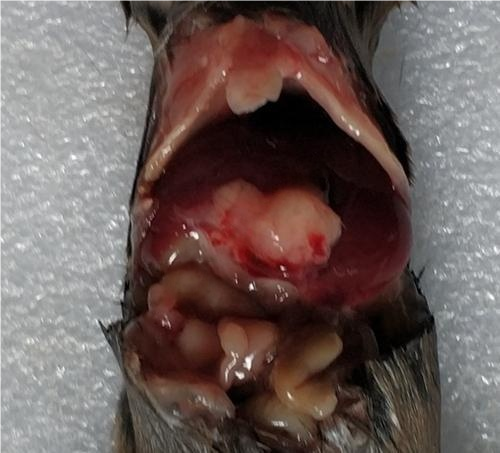
2 、肝转移瘤大体照片
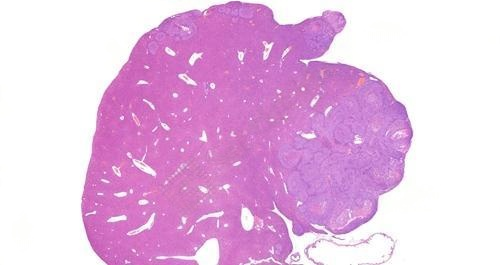
3、肝转移瘤HE染色
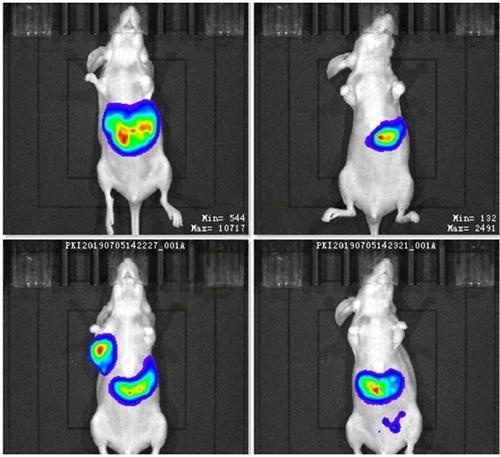
4、活体成像图
实验流程:
接收方案报价-预付款收取-细胞培养-动物订购-脾脏接种-成瘤指标监测-拍照取材-结果发送
送样运输要求:
冻存细胞需要直接寄到平台,尽量避免因温度转换导致细胞出问题
药品寄送要明确运输条件,储存温度,是否需要避光
寄送细胞和药品时间:周天-周三,特殊情况需和平台沟通确定,避免出现因未及时收货导致样品出现问题
寄送细胞和样品需要附送送样单(备注清楚细胞名称,培养条件等)送样单模板在后续附件中



