
铜死亡(Cuproptosis)深度解析
1.机制详解
铜死亡是一种新型的铜依赖性细胞死亡方式,由过量铜离子触发,其核心机制涉及对线粒体代谢的关键干扰:
铜离子与脂酰化蛋白结合:铜离子直接靶向三羧酸循环(TCA)中的脂酰化酶(如丙酮酸脱氢酶复合体),破坏其结构,导致毒性蛋白聚集和线粒体功能崩溃。
线粒体毒性应激:铜积累引发活性氧(ROS)爆发,同时抑制谷胱甘肽等抗氧化系统,加剧氧化损伤。关键蛋白FDX1(铁氧还蛋白1)可能参与调控这一过程,与硫辛酸代谢通路密切相关。
代谢失衡:TCA循环受阻导致ATP合成减少、代谢中间产物堆积,进一步激活细胞死亡信号。
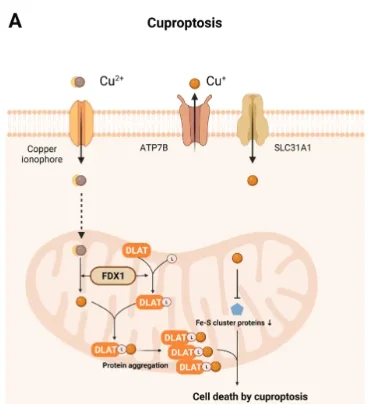
与其他死亡方式的区别:不同于凋亡(依赖Caspase)、坏死性凋亡(RIPK1介导)或铁死亡(脂质过氧化),铜死亡的特征是铜特异性的线粒体代谢崩溃,且不依赖传统死亡通路。
2.热点研究领域
(1)铜代谢异常与疾病关联
癌症:某些肿瘤(如肝癌、乳腺癌)中铜转运蛋白(ATP7A/7B)表达异常,导致胞内铜蓄积。铜死亡可能成为靶向癌细胞的“阿喀琉斯之踵”,尤其针对代谢活跃的肿瘤。
神经退行性疾病:阿尔茨海默病和帕金森病患者脑内铜稳态失调,铜沉积可能通过铜死亡加速神经元死亡。研究聚焦于铜螯合剂(如Clioquinol)的神经保护潜力。
(2)治疗策略开发
铜螯合剂:四硫钼酸盐(TTM)通过降低游离铜水平,已进入威尔逊病和癌症临床试验(如NCT04452124)。但需平衡疗效与全身铜缺乏风险。
铜离子载体:如Elesclomol将铜选择性递送至癌细胞,诱导铜死亡。II期临床试验显示其对黑色素瘤的部分疗效,但需优化靶向性以减少毒性。
(3)线粒体代谢重编程
代谢适应与耐药:肿瘤可能通过上调铜外排泵(CTR1)或增强谷胱甘肽合成抵抗铜死亡。靶向FDX1或硫辛酸通路可增强铜死亡敏感性。
联合疗法:铜死亡诱导剂与化疗、免疫检查点抑制剂联用,可能克服肿瘤代谢异质性,例如PD1抑制剂增强铜离子载体的抗肿瘤免疫应答。
3.研究优势与挑战
优势
新颖性:2022年Science期刊首次定义铜死亡(Tsvetkovetal.,2022),机制探索处于爆发期,易产出高影响力成果。
转化潜力:直接链接金属代谢与疾病,已有工具药(如Elesclomol)可快速推进临床前研究。
交叉性:整合代谢组学、金属组学与结构生物学,推动多学科突破。
挑战
机制未明:铜离子如何特异性识别靶蛋白?是否存在其他关键调控分子?
生物标志物缺乏:需发现指示铜死亡的特异性标记(如特定脂酰化蛋白修饰)。
递送难题:如何实现铜离子载体在肿瘤组织的精准富集,避免全身毒性?
4.未来方向
基础研究:解析铜死亡的分子开关(如FDX1的调控网络),利用冷冻电镜揭示铜蛋白复合物结构。
临床转化:开发肿瘤铜代谢成像技术(如64CuPET),筛选铜死亡敏感人群;优化铜离子载体纳米递送系统。
疾病拓展:探索铜死亡在心血管疾病(如心肌缺血再灌注损伤)中的作用。
总结
铜死亡为癌症和退行性疾病提供了全新视角,其研究兼具科学价值与应用前景。研究者需把握这一窗口期,深入解析机制并推动临床转化,同时关注铜稳态的复杂调控网络,以规避潜在治疗风险。