
Co-IP实验原理 Co-IP(Co-Immunoprecipitation)即免疫共沉淀,以抗体和抗原之间的专一性互作为基础,用于研究蛋白质相互作用的经典方法,是确定两种蛋白质在完整细胞内生理性相互作用的有效技术;属于免疫沉淀技术的一类,常被用于鉴定特定蛋白复合物的中未知蛋白组分。
免疫共沉淀的设计理念是,假设一种已知蛋白是某个大的蛋白复合物的组成成员,那么利用这种蛋白的特异性抗体及能与抗体结合的proteinA/G珠就可能将整个蛋白复合物从溶液中“拉”下来(即pull-down),达到富集该蛋白复合物的目的;进而通过质谱的方式鉴定这个蛋白复合物中的其他未知成员或通过WB验证已知蛋白是否与预测蛋白结合。免疫共沉淀的特点可以概括为两点,第 一是天然状态,第二是蛋白复合物。
相较于其他分子间相互作用检测方法(GST pull down等),免疫共沉淀实验的优势在于蛋白的结合在细胞内完成,能够反应天然状态下的蛋白质相互作用,结果更加真实可靠。
Co-IP实验流程
1:用预冷的磷酸缓冲液洗涤细胞两次,一次吸干磷酸缓冲液;
2:加入预冷的RIPABuffer(1ml/10^7个细胞、10 cm培养皿或150 cm2培养瓶,0.5 ml/5×10^6个细胞、6cm培养皿、75cm2培养瓶);
3:用预冷的细胞刮子将细胞从培养皿或培养瓶上刮离,把悬液转移到干净的1.5ml EP管中。并置于低速摇床,4℃缓慢晃动15min(EP管插冰上,置水平摇床上);
4:4℃,14000rpm离心15min,立即将上清转移到一个新的离心管中;
5:将Protein A/G琼脂糖珠用磷酸缓冲盐溶液洗两遍,用磷酸缓冲盐溶液配制成50%的Protein A/G琼脂糖珠工作液,建议减掉枪尖部分,避免在涉及琼脂糖珠的操作中破坏琼脂糖珠;
6:在样品中以每1ml中加100μl的比例,加入50%的Protein A/G琼脂糖珠工作液。水平摇床4℃摇动10min(EP管插冰上,置水平摇床上),该步骤的目的是去除非特异性结合的蛋白;
7:4℃,14000rpm离心15min,将上清转移到一个新的离心管中,去除Protein A/G琼脂糖珠;
8:做蛋白标准曲线(Bradford 法),测定蛋白浓度,测前将总蛋白至少稀释1:10倍以上,以减少细胞裂解液中去垢剂的影响(定量,分装后,可以在-20℃保存一个月);
9:用磷酸缓冲液将总蛋白稀释到1μg/μl以降低裂解液中去垢剂的浓度。如果觉得你的目的蛋白的浓度低了,可以将总蛋白浓度提高到10μg/μl(假设浓度足够);
10:加入一定体积的抗体到500μl总蛋白中,抗体的稀释比例因与它有作用的蛋白在不同细胞系中的多少而异;
11:4℃缓慢摇动抗原抗体混合物过夜或室温2h;激酶或磷酸酯酶活性分析建议用2h室温孵育;
12:加入100μl Protein A琼脂糖珠来捕捉抗原抗体复合物,4℃缓慢摇动抗原抗体混合物过夜或室温1h,如果所用抗体为鼠抗或鸡抗,建议加2μl过渡抗体;
13:14000rpm瞬时离心5s,收集沉淀,并且用预冷的洗涤缓冲液(或者预冷的磷酸缓冲盐溶液)洗涤3遍(每次加入800μl),RIPA Buffer有时候会破坏琼脂糖珠-抗原抗体复合物内部的结合,可以使用磷酸缓冲盐溶液;
14:用60μl 2×上样缓冲液将琼脂糖珠-抗原抗体复合物悬起,轻轻混匀,缓冲液的量依据上样多少的需要而定(60 μl足够上三道);
15:以游离抗原,抗体,珠子,离心,将上清电泳,收集剩余琼脂糖珠,上清也可以暂时冻-20℃,留待以后电泳,电泳前应再次煮5min变性;
注:RIPA配制:150mM Nacl,1%乙基苯基聚乙二醇,1%脱氧胆酸钠,25mM Tris-HCl缓冲液(PH7.6),0.1%SDS。
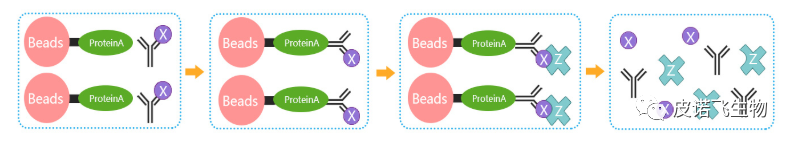

Co-IP实验对照设置
为了确保得到的结果是天然状态下的相互作用,而不是由于某些方面造成的人工相互作用(也就是“假阳性”),在Co-IP的实验设计过程中,需要设置正确的对照。
假设Co-IP实验的实验组为“磁珠+抗X抗体+靶蛋白X+目的蛋白Y”,则可能出现的“假阳性”及对应需要设置的实验对照如下表所示:

上述为了避免出现“假阳性”的对照称为阴性对照,除此之外Co-IP实验还会设置一个阳性对照组(Input组),Input组为直接利用抗体X(抗体Y)对细胞裂解液进行WB检测,验证细胞裂解液中存在蛋白X(抗体Y)。
在某些Co-IP实验中,实验人员会把IP后的上清分别进行蛋白X和蛋白Y的WB检测,该对照组称为output组。
利用内源性Co-IP实验为验证两个蛋白是否存在已知作用,如果结果为阳性,则可以证明两个蛋白之间存在相互作用;但如果结果为阴性,无法证明两个蛋白之间不存在相互作用,也有可能是蛋白在细胞内表达量低等原因导致。因此在进行内源性Co-IP验证两个蛋白是否存在相互作用时,建议先做过表达Co-IP作为对照。
Co-IP实验技术应用
免疫共沉淀实验可以用于:
1. 测定两种目标蛋白质是否在体内结合
2. 确定一种特定蛋白质的新的作用搭档
3. 分离得到天然状态的相互作用蛋白复合物
随着对蛋白质研究的不断深入,人们将免疫沉淀方法与其他方法结合起来,在其基础上衍生出许多较为复杂的技术,从而使得分析方法更为多样化,它的应用范围也相当的广泛。免疫共沉淀是用来研究蛋白质与蛋白质相互作用的一种技术,可以应用于蛋白复合物的研究。它可验证蛋白复合物的存在,进而发现新的蛋白复合物;免疫共沉淀技术与免疫印迹法或质谱等方法结合,用于确定诱饵蛋白-目的蛋白在天然状态下的结合情况,确定特定蛋白质的新作用搭档。免疫共沉淀实验也可以应用于低丰度蛋白的富集和浓缩。
同时免疫共沉淀技术是一个相对比较经典的探讨蛋白质间相互作用的技术,在现代医学研究中应用范围广泛且可信度较高。蛋白质之间相互作用渗透于机体每一个细胞的生命活动过程中,生物学中会出现很多现象如复制、转录、翻译、剪切、分泌、细胞周期调控、信号传导和中间代谢等都受到蛋白质间相互作用的调控。有些蛋白质由多个亚单位组成,蛋白质之间的相互作用就显得尤为普遍。又有些蛋白质结合得十分紧密;而有些蛋白质却只有短暂的相互作用。可是不论出现哪些种情况,它们都控制着大量的细胞生命活动的事件,比如细胞的增殖、分化和死亡。且通过蛋白质之间的相互作用,能改变细胞内蛋白质的动力学特征,比如底物结合特性、催化活性,也可以产生新的结合位点,对改变蛋白质对底物的特异性有作用,还可以使其他蛋白质失活,其他基因表达得到调控。因此,只有让蛋白质之间相互作用得以顺利进行,细胞的正常生命活动过程才会得到保障。因为蛋白质之间相互作用具有如此重大的意义,所以它的检测方法的研究也备受关注与重视。自此以后蛋白相互关系的研究会愈演愈烈,未来不仅仅可以通过免疫共沉淀技术来证实,还将会有越来越多的先进技术值得去应用和发展。
注意事项
1. 细胞裂解采用温和的裂解条件,不能破坏细胞内存在的所有蛋白质-蛋白质相互作用,多采用非离子变性剂(NP40 或Triton X-100)。每种细胞的裂解条件是不一样的,通过经验确定。不能用高浓度的变性剂(0.2%SDS),细胞裂解液中要加各种酶抑制剂,如商品化的。
2. 使用明确的抗体,可以将几种抗体共同使用。
3. 使用对照抗体:
单克隆抗体:正常小鼠的IgG或另一类单抗
兔多克隆抗体:正常兔IgG
4. 确保共沉淀的蛋白是由所加入的抗体沉淀得到的,而并非外源非特异蛋白,单克隆抗体的使用有助于避免污染的发生。
5. 要确保抗体的特异性,即在不表达抗原的细胞溶解物中添加抗体后不会引起共沉淀。
6. 确定蛋白间的相互作用是发生在细胞中,而不是由于细胞的溶解才发生的,这需要进行蛋白质的定位来确定。